Le dispositif français de prévention et de gestion des pénuries

28 mai 2020
BLUEREG GROUP
La réglementation française en matière de prévention et de gestion des ruptures de stock de médicaments s'inscrit dans le cadre juridique européen défini par la directive 2001/83/CE dont un article (le 81) pose le principe de la responsabilité des industriels et des distributeurs dans l'approvisionnement approprié et continu du marché et un autre (le 23 bis) prévoit une notification obligatoire de l'autorité compétente nationale par l'industriel exploitant de toute indisponibilité provisoire ou définitive du médicament ( au plus tard deux mois avant l'interruption de la mise sur le marché du médicament.).
La lutte contre les pénuries de médicaments a été renforcée par la Loi n°2016-41 du 26 janvier 2016 de modernisation de notre système de santé dite loi « Santé ». Celle-ci a placé les médicaments d’intérêt thérapeutique majeur (MITM), au cœur du dispositif de prévention et de gestion des ruptures de stock.
____________________
[On entend par MITM (Article L5111-4 de la loi « Santé), les médicaments ou classes de médicaments pour lesquels une interruption de traitement :
- est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme,
- ou représente une perte de chance importante pour les patients au regard du potentiel évolutif de la maladie.]
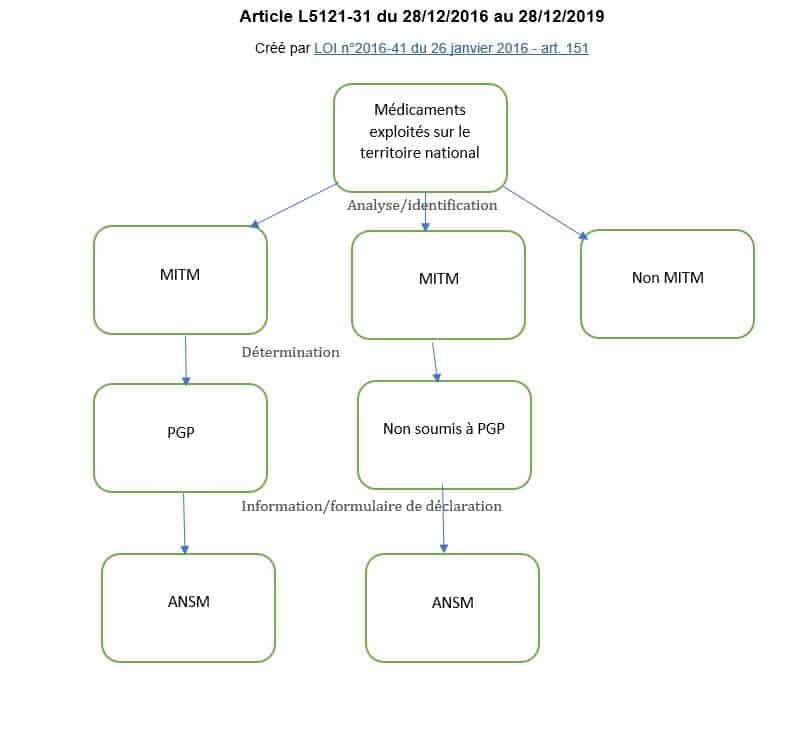
avec notamment un article de cette loi créé comme suit : Article L.5121-31
Pour les médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5111-4 pour lesquels, du fait de leurs caractéristiques, la rupture ou le risque de rupture de stock présente pour les patients un risque grave et immédiat, les titulaires d'autorisation de mise sur le marché et les entreprises pharmaceutiques exploitant des médicaments élaborent et mettent en œuvre des plans de gestion des pénuries dont l'objet est, dans l'intérêt des patients, de prévenir et de pallier toute rupture de stock…..
Or en 2018 l'Agence Nationale de Sécurité Sanitaire des Médicaments et des produits de santé (ANSM) a recensé dans son rapport d’activité annuel, 871 signalements de ruptures de stock et de risques de rupture de stock de médicaments. Ce nombre est en augmentation de plus de 64 % par rapport aux 530 signalements enregistrés en 2017, qui constituaient déjà un record.
Ainsi dans le cadre de la prévention et la gestion des pénuries de médicaments, le projet de Loi de Financement de la Sécurité Sociale (PLFSS) pour 2020 prévoit (dans son article 34) plusieurs dispositions dans le but de renforcer la régulation des ruptures de stock de médicaments essentiels.
On peut citer :
- L'instauration d'une obligation de constitution par les laboratoires d'un stock de sécurité pour les médicaments qu’ils soient MITM ou non (ce qui modifie l'article L. 5121-29 du code de la santé publique (CSP)). Il est prévu que cette obligation entre en vigueur à partir du 30 juin 2020
- Le renforcement de l'obligation des laboratoires d'informer l'ANSM en cas de rupture ou de risque de rupture d’un MITM (ce qui modifie l'article L. 5121-32 du CSP en introduisant les titulaires d'autorisation de mise sur le marché comme acteurs supplémentaires de l’information à l’ANSM
- L'instauration d'une obligation d'importation à la charge de l'entreprise défaillante (avec une réécriture de l'article L. 5121-33 du CSP)
- Le durcissement des sanctions susceptibles d'être prises à l'encontre des industriels ne respectant pas leurs obligations en matière d'approvisionnement approprié et continu du marché national (création d’un un nouvel article L. 5423-9 du CSP entièrement consacré aux manquements soumis à sanction financière)
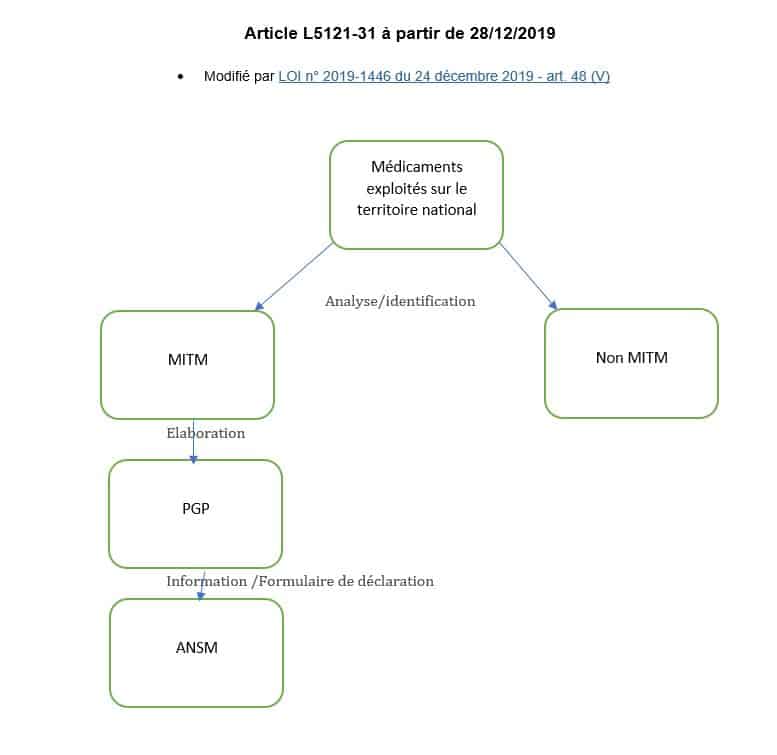
Puis la modification de l’article L.5121-31 sus- mentionné, par la LOI n° 2019-1446 du 24 décembre 2019 selon :
Pour les médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5111-4 , les titulaires d'autorisation de mise sur le marché et les entreprises pharmaceutiques exploitant des médicaments élaborent et mettent en œuvre des plans de gestion des pénuries dont l'objet est, dans l'intérêt des patients, de prévenir et de pallier toute rupture de stock…
La suppression dans l’article de la mention « pour lesquels, du fait de leurs caractéristiques, la rupture ou le risque de rupture de stock présente pour les patients un risque grave et immédiat, » rend obligatoire l’élaboration d’un plan de gestion de pénurie (PGP) pour tout MITM.
En effet dans la précédente version de cet article, les MITM ne faisaient pas forcément l’objet d’un PGP, l’industriel avait la charge d’identifier les MITM soumis à PGP en fonction des caractéristiques de ces médicaments précisées par décret (décret du 20 juillet 2016) et de leur appartenance aux classes thérapeutiques de MITM définies par arrêté du ministre chargé de la santé (arrêté du 27 juillet 2016).
SCHÉMATIQUEMENT pour un industriel :
A titre indicatif, la rédaction d’un PGP peut se faire en suivant le plan suivant :
I Informations générales sur le MITM
II Éléments de fragilité identifiée lors de l’analyse de risque (de la fabrication à la distribution du MITM)
III Mesures en place visant à prévenir et gérer les ruptures de stock et limiter les tensions voire les ruptures de stocks
- Surveillance, prévention, actions mises en place pour pallier la rupture
IV Mesures envisagées à moyen terme (si les mesures actuelles sont jugées insuffisantes)
Ajouter la fréquence de révision du PGP, les références et définitions et en annexe le formulaire de déclaration de rupture de stock de l’ANSM prérempli (notamment avec les informations du I)
Références :
- Code de la santé publique et en particulier les articles :
Art. L.5111-4
Art. L.5121-31 & Art. L.5121-32
- Loi n°2016-41 du 26 janvier 2016 de modernisation de notre système de santé – Art. 151 et loi n° 2019-1446 du 24 décembre 2019 - art. 48
- Décret n°2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d'approvisionnement de médicaments
- Arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique
- Circulaire LEEM : informations_types_pouvant_etre_integrees_au_pgp_pj_reco_pgp_2019
- ANSM rapport d’activité annuel 2017
BlueReg et son équipe de consultants expérimentés peuvent apporter un soutien complet dans la conception et la mise en œuvre d'un système de qualité répondant aux attentes réglementaires en France. Plus précisément sur :
- Plans d'urgence en cas de pénurie de médicaments (PGP) pour les médicaments d'intérêt thérapeutique majeur (MITM)
Pour plus d'informations, cliquez ici : https://blue-reg.com/market-specific-services-for-france/quality-system-and-audit/
ou contactez-nous : https://blue-reg.com/fr/nous-contacter/




